כימיה לבגרות/חימצון חיזור/אלקטרוליזה
קפיצה לניווט
קפיצה לחיפוש
מושגים
- חמצון חיזור – תהליכים בהם יש מעבר של אלקטרונים (-e). למשל :
- מחזר – חלקיק שמסר אלקטרון (עובר חמצון).
- מחמצן – חלקיק שמקבל אלקטרון (עובר חיזור).
אלקטרוליזה – פירוק חומר ע"י חשמל
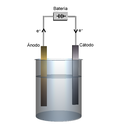
אלקטרוליזה (אלקטרו=חשמל; ליזה – אנליזה = פירוק חומר למרכיביו) היא דוגמא לתהליך חמצון חיזור בהם אנו מפרקים קשרים יונים קיימים. בכדי לפרק את הקשר עלינו להפעיל כוח חשמלי (העברת הזרם מתבצע ע"י כבל).
לחוט יש שני צדדים :
- אנודה/אלקטרודה – הצד החיובי של החוט אליו מתחבר היון השלילי (אניון). האניון עובר חמצון באנודה.
- אלקטרודה/קתודה – הצד השלילי של החוט אליו מתחבר היון החיובי (קטיון). הקטיון עבור חיזור בקתודה.
דוגמא
בכדי לפרק את הקשר ל - נכניס אל התערובת חוט.
במילים אחרות :
- ימשך אל הקתודה.
- ימשך אל האנודה.
הפעולה שתתבצע :
רשימת התהליך כימית (הסבר כללי, בהמשך פירוט רחב יותר והסברים)

שלב א'
הכנסת החומר למים ורשימת ניסוח :
שלב ב'
רשימת התהליך שעובר המחזר
| מחזר (אנודה) | |||
שלב ג'
איזון המשוואה; כיוון ש-Fe קיבל 3 אלקטרונים (ראה תמונה) בחזרה, משלוש מולקולות Cl, נרשום:
| מחזר (אנודה) | 3Cl- ---> 3Cl0 + 3e- | ||
שלב ד'
רשימת התהליך שעובר המחמצן:
| מחזר (אנודה) | |||
| מחמצן | |||
שלב ה'
חיבור הנתונים לקבלת הניסוח המלא. שימו לב, שהאלקטרונים מבטלים זה את זה (3 אלקטרונים שלילים, ושלושה חיובים):
| מחזר (אנודה) | |||
| מחמצן | |||
הערה : Cl (מטען אפס) מופיע כדו אטומי בטבע, ולכן, במקום לרשום 3Cl רשמנו Cl2 ואזנו ל- 1.5Cl2.